2022-02-28 1359

引用本文
曹寒,姚晨*,阎小妍,于永沛,尚美霞.基于博鳌乐城真实世界数据开展特许医疗器械临床研究的设计类型和统计分析方法探索[J].中国食品药品监管.2021.11(214):6-13.
基于博鳌乐城真实世界数据开展特许医疗器械临床研究的设计类型和统计分析方法探索
曹寒
北京大学第一医院
姚晨*
北京大学第一医院,北京大学临床研究所
海南省真实世界数据研究院
阎小妍
北京大学临床研究所
于永沛
北京大学临床研究所
尚美霞
北京大学第一医院
摘 要
使用海南博鳌乐城国际医疗旅游先行区真实世界证据支持特许医疗器械国内审批上市的需求不断增加,但是国内外相关真实世界数据用于药械监管决策的指导原则对于乐城的针对性非常有限。如何针对乐城的特点进行科学合理的研究设计并采取相应严谨的统计分析成为乐城真实世界数据研究亟待解决的问题。本文将分析乐城开展真实世界数据研究的关键特征,并针对这些特征探索适用于乐城的研究设计类型和统计分析方法。
关键词
博鳌乐城;特许医疗器械;真实世界数据;研究设计类型;统计分析方法

真实世界数据(real-world data,RWD) 是指来源于日常所收集的各种与患者健康状况和( 或) 诊疗及保健有关的数据[1-3],由其产生的真实世界研究(real-world study,RWS)和真实世界证据(real-world evidence,RWE) 对医疗器械监管的价值也受到了研究者和监管部门的广泛关注。美国食品药品监督管理局(Food and Drug Administration,FDA)在2017~2018 年相继颁布了《使用真实世界证据支持医疗器械监管决策指南》(Use of Real-WorldEvidence to Support Regulatory Decision Making for Medical Devices)[2] 和《FDA 真实世界证据计划框架》(Framework for FDA's Real-World Evidence Program)[1], 我国国家药品监督管理局(National Medical Products Administration ,NMPA)在2020 年发布《真实世界数据用于医疗器械临床评价技术指导原则(试行)》[3],均为使用RWD/RWE 评价医疗器械有效性的探索提供了基本构架。
海南博鳌乐城国际医疗旅游先行区是海南自由贸易港战略之一。2018 年, 国务院赋予海南省政府对乐城临床急需进口医疗器械和药品特许使用的独特政策,使乐城成为目前我国唯一可以使用国外已批准上市、国内未经注册的特许药械的地区。目前,乐城已开展2 批医疗器械产品的真实世界数据研究,受到了医疗企业和社会的广泛关注,使用乐城真实世界数据支持医疗器械审批上市的需求不断增加[4]。乐城具有特有的政策支持,而国内外相关真实世界数据用于药械监管决策的指导原则对于乐城的针对性非常有限。如何针对乐城的特点进行科学合理的研究设计并采取相应严谨的统计分析成为乐城真实世界数据研究亟待解决的问题,也是实现乐城真实世界数据向可用于特许医疗器械国内审批注册真实世界证据转化的关键环节。本文将分析乐城开展真实世界数据研究的关键特征,并针对这些特征探索适用于乐城的研究设计类型和统计分析方法。
1、乐城开展特许医疗器械真实世界数据研究的关键特征
乐城由于其特有的政策支持,以及医疗器械、患者来源、诊疗地点和数据采集的特点[4-5],其开展真实世界数据研究具有如下3 个关键特征:①特许医疗器械已经在国外批准上市,存在国外临床数据,并已经获得成功临床应用经验,具有较丰富的既往证据资料;②特许医疗器械在乐城进行的真实世界数据研究为支持其国内注册上市的证据补充材料,证明其在国内具有与国外相当的有效性和安全性,在保证研究质量的前提下不需重复开展大规模的临床研究;③特许医疗器械在乐城的使用对象为急需此类器械诊疗的就医患者,难以进行随机分组和设立同期内部对照,通常只能产生特许医疗器械单组临床指标数据。以上特征决定了在乐城开展的真实世界数据研究不同于其他地区常规情形下真实世界数据研究的思路框架。
2、适用于乐城特许医疗器械真实世界数据研究的设计类型
根据乐城特许医疗器械真实世界数据研究的3 个关键特征,即具有境外临床研究证据、仅需国内证据作为注册的补充材料以及乐城真实诊疗环境下只能产生特许医疗器械单组临床指标数据,单组目标值研究和基于外部对照的单组研究是较为适合的2 种研究设计类型。
2.1 单组目标值研究
单组目标值研究是指在通过无同期对照的单组临床研究,考察产品主要评价指标的结果是否在事先指定的目标值范围内,来评价该产品有效性和安全性的方法。单组目标值(objective performance criteria,OPC)是指专业领域内公认的产品有效性或安全性指标应达到的标准[6],一般通过临床试验监管部门指南、行业标准或专家共识和同类产品历史研究结果来确定[7]。针对乐城特许医疗器械已有境外临床应用经验,且难以随机分组和设立同期内部对照的特点,以境外临床研究评价指标和(或)指南标准作为OPC 的实效性研究或观察性研究,可作为实效性随机对照研究的替代策略,为特许医疗器械国内注册提供关键证据。但仍需注意的是,单组目标值研究没有同期平行对照,混杂偏倚难以控制。此外,在对不良事件与产品的相关性,以及不良事件发生率的高低进行评价时,缺少对照组提供参考和佐证[7]。因此,单组目标值研究更适用于安全性良好且不良事件发生率很低的特许医疗器械的评估。虽然单组目标值研究设计契合乐城真实世界数据研究的特点,但由于该设计类型固有的局限性,建议相应特许医疗器械临床研究申办方在研究方案设计阶段与临床医学专家、生物统计学家和法规监管部门进行沟通和协商,达成共识后再开展基于OPC 的实效性研究或观察性研究,以规避产品评价风险。
2.2 基于外部对照的单组研究
由于乐城就医的患者均对特许药械有迫切需求,设立同期内部对照不具有可行性。单组目标值研究因缺少对照组提供参考,导致其适用范围存在一定的局限性。因此,考虑在乐城外的国内医疗机构将按常规诊疗的人群设立为外部对照,评价特许医疗器械相对于常规诊疗的安全性和有效性。国内疾病登记数据、自然人群队列和专病队列等已积累海量数据[4],为外部对照的设立提供了丰富的资源。此外,也应考虑将特许医疗器械国外临床研究数据作为外部对照,对该器械在乐城国内人群的疗效进行非劣效检验。但是,无论是何种来源的外部对照,与乐城患者均不是同一个总体,偏倚控制仍然是影响研究结果的关键问题。这些影响研究结果的因素涉及范围很广,包括人口学特征、诊断标准、诊断技术、疾病分期或亚型、疾病严重程度、伴随用药、观察条件、评价指标和评价标准等。除此之外,可能还包括很多非常重要但未被识别的或无法测量的因素等。因此,在选择外部对照时应尽可能选择基本特征具有同质性的人群,统计分析阶段也需要通过适当的统计分析方法进行偏倚的控制,后文将具体阐述真实世界数据研究偏倚控制的常用统计学方法。
2.3 单组研究的拓展研究设计类型
国际人用药品注册技术协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH) 于1988 年发布的E5 指南首次提出桥接试验(bridging study)的概念:新药在原地域已经通过审批以后,如果要推广到新地域,可以利用原地域临床试验已有信息,按需在新地域进行小规模的附加试验研究,通过这些试验研究说明该药品对新地域人群具有同样的安全性、有效性,即可有效、快速地将原地域药品外推到新地域。桥接思想在国际多中心临床试验(multi-regional clinical trial,MRCT) 提交目标区域审批时已得到了广泛的应用,即目标区域药品审评机构要求在适量样本的MRCT 框架外,补充针对目标区域人群的局部区域临床试验(local clinical trial,LCT), 此种策略已成为目前新药国际研发的趋势[8]。三臂非劣效试验设计给上述桥接策略在定性和定量评价目标区域药物有效性和安全性方面提供了积极的启示:该试验设计包含试验组、阳性对照组和安慰剂组,既能检验试验组是否优于安慰剂组,又能检验试验组是否非劣效于阳性对照组,同时通过证明阳性对照组的测定灵敏度和稳定性,进一步确证试验药物的有效性[9]。有学者[10] 在三臂非劣效试验设计的基础上,将MRCT+LCT 的框架整合为一种新的类三臂非劣效试验设计的桥接策略,即在MRCT 药物有效性确证的基础上,借用已有的MRCT 疗效信息开展针对目标区域人群的LCT,验证药物在LCT是否有效,且非劣效于MRCT 的整体疗效。
乐城特许医疗器械均已在国外进行了有效性和安全性的确证研究,需要通过乐城小样本实践的真实世界数据,验证其在我国人群中是否有效,且非劣效于该器械在国外临床研究中的效果。MRCT+LCT 框架下的类三臂非劣效试验设计的桥接策略为解决乐城特许医疗器械效果评价的上述问题提供了新的思路:将“2.2基于外部对照的单组研究”中提及的2 种外部对照的研究设计,即以国内常规诊疗为外部对照的单组研究和以国外临床研究数据为外部对照的单组研究进行整合转化(图1)。将国外和国内2 个常规治疗组类比为三臂非劣效试验设计中的阴性对照臂,对试验器械是否有效进行定性判断,称为类阴性对照臂;将乐城试验器械组类比为三臂非劣效试验设计中的试验臂;将国外临床研究中的试验器械组类比为阳性对照臂,对试验器械的有效性进行定量度量。基于这种框架,假设试验器械在乐城的疗效是非劣效于国外临床研究结果,以国外临床研究中试验器械与常规治疗疗效差的百分比作为非劣效界值,通过非劣效检验来确证试验器械在乐城的疗效:①试验器械相对于常规治疗的有效性;②保留了试验器械在国外疗效的百分比;③非劣效于试验器械在国外的疗效。此种新型研究设计框架仍需乐城实际案例验证其适用性。此外,此种研究设计中的阴性对照和阳性对照均属于外部对照,偏倚仍然不可避免。因此,在乐城特许医疗器械真实世界数据研究中,偏倚控制是所有研究类型均需要慎重考虑的关键环节。

3、适用于乐城特许医疗器械真实世界数据研究的统计分析方法
3.1 单组目标值研究常用统计分析方法
单组目标值研究结局指标评价的常用统计分析方法主要分为2 类:假设检验法和置信区间法[7, 11- 12]。单组目标值研究的假设检验为单侧检验,根据研究目的可将结局评价指标分为高优指标(如有效率)和低优指标(如不良事件发生率)。设θ1 为结局指标的总体参数,θ0 为结局指标的OPC,则单组目标值研究的假设检验为:①对于高优指标:H0 :θ1 ≤ θ0,H1 :θ1>θ0 ;② 对于低优指标:H0 :θ1 ≥ θ0,H1 :θ1<θ0,检验水准(α)常取0.025。当单侧检验P ≤ α 时,拒绝H0,接收H1,认为试验器械满足设计要求。当结局指标为定性指标,即对率进行假设检验:①目标值π0 或预期总体参数π1 远离0% 或100%(介于10%~90%),同时样本量较大(至少50 例以上),建议采用正态近似法;②当目标值π0 或预期总体参数π1 接近0%或100%(<10% 或>90%),正态近似法可能增加Ⅰ类错误,建议此时采用更为精确的确切概率法。
单组目标值研究结局指标的评价也可以通过结局指标的置信区间和OPC 的比较来实现。对于高优指标,当试验器械的结局指标(1-2α)% 双侧置信区间的下限高于OPC 时,认为试验器械满足设计要求;对于低优指标,当试验器械的结局指标(1-2α)%双侧置信区间的上限低于OPC时, 认为试验器械满足设计要求。当结局指标为定性指标,即对率进行置信区间估计:①目标值π0 或预期总体参数π1 远离0%或100%,同时样本量较大,建议采用正态近似法;②当目标值π0 或预期总体参数π1 接近0% 或100%,建议采用Miettinen 确切估计法或Wilson计分区间法[13-14]。
乐城试验器械研究人群可能同时包括多个亚组人群,如不同疾病分期或亚型人群以及不同疾病严重程度人群,人群构成不同可能会引起目标值的不同。这时,可以采用加权的方法进行多亚组复合终点目标值的计算,即按照各亚组人群样本量占总样本量的比例,赋予对应亚组人群OPC相应的权重,然后以总体研究人群加权OPC 作为该试验器械结局指标评价的标准。例如,评价某髂骨静脉支架疗效的临床研究,根据文献确定主要评价指标为支架置入后的血管通畅率。研究人群分为栓塞型髂骨静脉阻塞(post-thrombotic,PT) 组和非栓塞型髂骨静脉阻塞(non-thrombotic,NT) 组2 个亚组,假定75% 研究对象为PT 组,25% 研究对象为NT 组。根据相关文献估计,PT 组和NT 组研究对象血管通畅率分别为77.6% 和95.5%,则加权OPC 为82.1%。结局指标和加权OPC 的比较,仍然可以采用上述的假设检验法和置信区间法实现。
3.2 基于外部对照的单组研究及其拓展研究设计类型统计分析方法
基于外部对照的研究设计类型的统计分析思想均可归纳为非劣效检验,即乐城试验器械疗效非劣效于该试验器械国外临床研究中的疗效。因此, 可将非劣效检验统计方法应用于乐城医疗器械疗效的评价。FDA 发布的《非劣效临床试验指南》(Non-Inferiority Clinical Trials) 中提出使用双置信区间法进行非劣效临床试验的统计推断[15]。xNT 和xOT分别表示试验器械在乐城临床研究和国外临床研究中的疗效,xNP和xOP 分别表示常规疗法在国内和国外临床研究中的疗效。假设xNT、xOT、xNP 和xOP 分别满足正态分布N(μNT,σNT2)、N(μOT,σOT2)、N(μNP,σNP2)和N(μOP,σOP2), 试验器械指标指定为高优指标。取试验器械在国外临床研究中的疗效μOT - μOP 的点估计值
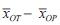
的100(1-δ)% 的置信区间下限作为试验器械在国外应用的效果, 将其记为M1, 即
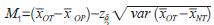
,此为试验器械在国外应用疗效的保守估计。对于任意的0 ≤ λ ≤ 1,当希望试验器械在乐城的疗效能保留在国外应用疗效至少100λ% 的效果时, 令M2=(1-λ)M1,规定M2 为非劣效检验中使用的边界值,则有双置信区间法的非劣效假设检验为:
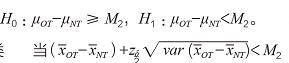
则拒绝H0,认为试验器械在乐城临床研究中的疗效非劣效于在国外应用的疗效。
此外,也可以按照桥接研究的思路,对试验器械在乐城的疗效和在国外临床研究中的疗效进行相似性判定。目前,用于相似性检验的经典统计方法主要包括3 类:两阶段设计和成组序贯设计法、加权z 检验法以及重建概率和概括概率法[16-17]。两阶段设计和成组序贯设计法是将桥接研究视为一个整体下分原地域阶段(国外临床研究阶段)和新地域阶段(乐城临床研究阶段)两部分进行的临床研究[18-19]。当乐城临床研究阶段完成后,对国外临床研究和乐城临床研究的累计数据进行统计分析。若检验统计量TN 大于预定界值CN,则认为可以将试验器械国外临床研究结果外推至国内。桥接研究中加权z 检验法的基本思路是将原地域和新地域的近似正态性z 检验统计量按照预先指定的权重相加,得到新的统计量再进行假设检验[20]。zN和zO 分别表示试验器械乐城临床研究和国外临床研究的z 检验统计量,w 表示权重,则加权统计量
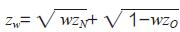
。此时对zw 进行假设检验,若小于预定检验水准α,则认为桥接成功。重建概率是指在相同条件下,新地域重复原地域研究结果的概率;概括概率是指已有信息表明新地域和原地域的疗效可能存在差异的条件下,在新地域得到疗效存在的概率[21-23]。用重建概率和概括概率法检验是否成功桥接的本质就是新地域是否能够达到预先规定的可重复性概率,如果能够满足,则将原地域的临床研究数据借用到新地域。以上3 类经典统计分析方法均属于频率方法,由于需要借助外来信息,容易引起Ⅰ类错误膨胀等问题,可能导致这些桥接策略无法通过监管部门的审批[17]。
桥接研究的思路是通过原地域已掌握药械的有效性和安全性信息,支持药械在新地域的快速上市, 这与Bayes 统计理念十分契合[17]。乐城试验药械通常已具有国外临床研究结果,因此相对于经典频率方法,Bayes 方法可能在乐城特许医疗器械真实世界数据研究中更有用武之地。经验Bayes 在桥接研究中应用的基本思想为利用总体参数后验概率建立相似性判断标准[24]。具体做法为将原地域试验器械组和常规治疗组的疗效差值作为新地域的先验,以新地域试验器械组和常规治疗组的疗效差值作为现有数据, 利用经验Bayes 方法计算新地域试验器械组与常规治疗组疗效差值的后验概率。μNT和μP 分别表示新地域试验器械组和常规治疗组的总体均值,则新地域疗效的后验概率需满足:PSI=Pr { μNT-μP>0|bridging data and prior}>1-α,其中PSI可视为相似性的判断标准。如果进一步引入非劣效检验的思想,即计算新地域和原地域疗效差值大于一个固定的非劣效界值的概率,则可以实现对新地域试验器械有效性的定量度量。此时, 新地域疗效的后验概率需满足:PSI=Pr{μNT-μOT>-δ|bridging data and prior}>1-α,其中μOT 为原地域试验器械组的总体均值,δ 为预先指定的非劣效界值。但是,上述相似性判断方法很大程度上依赖于原地域的样本信息,而原地域的数据样本量往往远大于新地域,使其在后验分布的计算上占主导地位,新地域的结果往往无法“扭转”原地域结果,容易得到区域间相似的结论。混合先验Bayes法通过2 个按一定权重相加的分布函数组成总体参数的先验分布,来削弱原地域样本含量过大所造成的“主导”影响[25]。其中一个分布函数是由原地域已知的数据确定,而另一个分布函数则使用无信息先验分布。但是,由于权重的取值需要人为指定,往往缺乏实际意义,因此在实际应用中很难抉择其合理的取值。
需要注意的是,以上统计分析方法均是对试验器械在新地域和原地域疗效的定性判定和非劣效验证,对新地域试验器械相对于常规疗法的灵敏度和稳定性解释非常有限。针对乐城的情况,可以参考类三臂桥接非劣效研究设计(图1),但是相关假设检验和适用的统计分析方法还需要进一步推导和评价。
3.3 混杂偏倚控制常用统计分析方法
由于大多数真实世界数据研究中没有随机化过程(实效性临床试验除外),混杂偏倚几乎是所有真实世界研究设计类型共同面临的问题。中国真实世界数据与研究联盟(ChinaREAL) 在2019 年发布的《基于真实世界数据评价治疗结局研究的统计分析技术规范》[26], 以及NMPA在2020 年发布的《真实世界数据用于医疗器械临床评价技术指导原则(试行)》[3] 均对真实世界数据研究中混杂偏倚的控制策略和常用统计分析方法进行了详细的说明。有效的统计描述和选取合适的统计模型均是混杂偏倚控制的关键环节。常用的多变量分析方法包括多重线性回归模型、logistic 回归模型、cox 比例风险回归模型以及相应多水平模型等。除传统多变量分析方法,基于因果推断的模型也被广泛地应用于疗效评价的统计分析中,如倾向性评分、工具变量、边际结构模型和结构方程模型[26]。对于乐城特许医疗器械真实世界数据研究,由于研究设计大多为单组研究,上述控制混杂的统计分析方法应用范围可能比较受限,在设立外部对照的研究设计中可能有所应用。对于乐城大多数单组研究,根据可能的混杂因素进行分层分析以及全面的敏感性分析可能是更具有可行性的混杂偏倚识别和控制策略。
4、结 语
海南博鳌乐城国际医疗旅游先行区特许医疗器械真实世界数据研究目前处于起步阶段,需要尽快构建适用于乐城真实世界数据研究设计以及评价和推导相关的统计分析方法,有效结合国外已有临床研究数据,实现特许医疗器械在国内的快速审批上市。本文通过分析乐城特许医疗器械真实世界数据研究的关键特征,提出相对合理可行的研究设计和对应的统计分析思路,但尚需要通过乐城真实案例的应用进行比较和评价。
第一作者简介
曹寒,博士后,北京大学第一医院医学统计室。专业方向:临床研究统计设计与分析
通讯作者简介
姚晨,卫生统计学硕士,教授,临床研究方法学博士生导师,北京大学第一医院医学统计室主任,兼任北京大学临床研究所副所长和海南省真实世界数据研究院副院长。专业方向:临床研究统计设计与分析