2022-07-18 3808
2019年,海南省人民政府与国家药监局联合启动海南临床真实世界数据应用试点工作,在博鳌乐城国际医疗旅游先行区范围内,探索将临床真实世界数据用于药品医疗器械产品注册和监管决策实践。2020年以来,国家药监局及有关部门陆续发布多个真实世界研究相关的技术指导原则,以规范开展真实世界研究。那么什么是真实世界研究呢?现在我们就揭开它神秘的面纱。
✦
什么是真实世界研究?
✦
真实世界研究就是收集各种与患者健康状况、诊疗及保健有关的数据,并加以治理分析,获得真实世界证据的研究过程。

真实世界研究所产生的真实世界证据既可用于支持或辅助支持药械监管决策,涵盖上市前临床研究以及上市后再评价,也可用于其它科学目的,如针对某类病人临床决策、优化给药剂量完善治疗方案等。

✦
真实世界数据有哪些来源?
✦
真实世界数据来源广泛,包括医院信息系统、医保支付数据、药品安全性主动监测数据、个人健康监测数据等十余种来源。
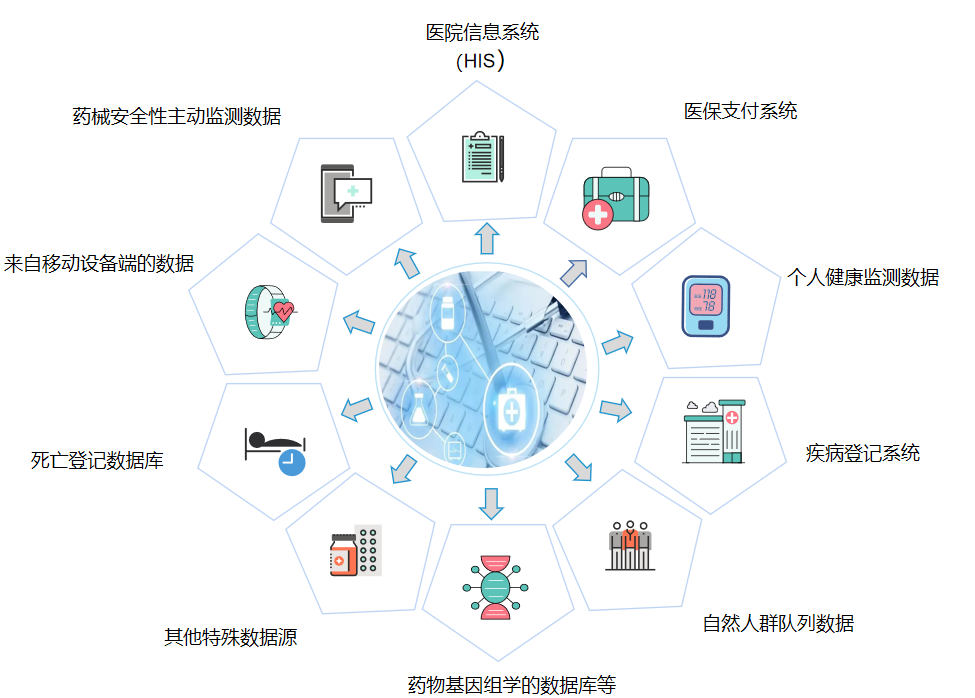
真实世界研究并非简单的数据采集,而是在真实医疗环境中获得质量可靠的数据,经过数据治理,以回答特定的临床问题。高质量的真实世界数据是开展真实世界研究的基础。真实世界数据的来源、收集与治理的全过程应透明、清晰、可溯源。研究者可根据研究开展的时间,采用回顾性收集或前瞻性收集方式获取真实世界数据。
✦
如何评估真实世界证据能否支持临床所关注的科学问题呢?
✦
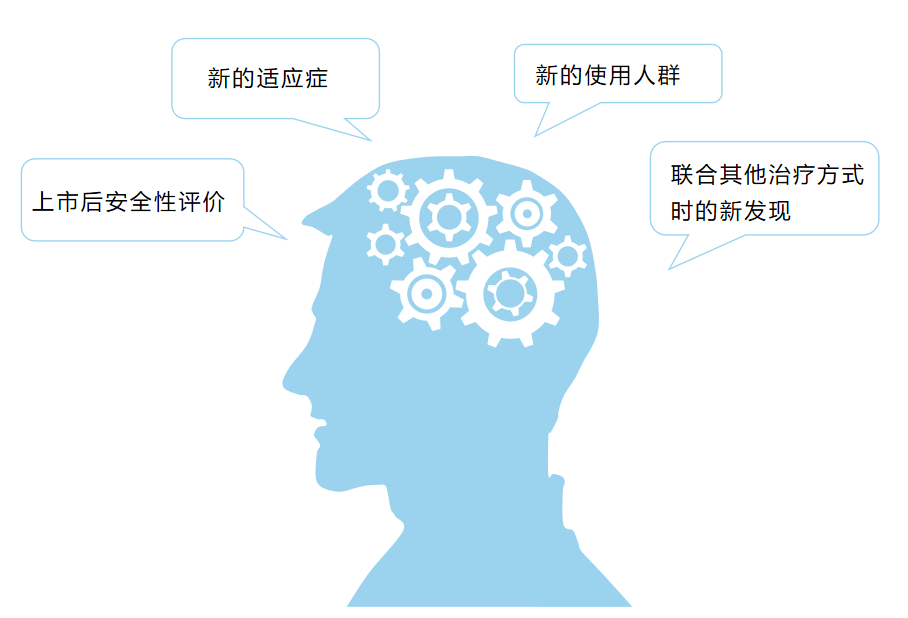
首先应明确需要回答的临床问题,其次需要考虑经治理的真实世界数据是否能够回答所关注的临床问题,可以从以下四个方面综合评价:

真实世界研究作为一种新的临床研究方法,同样需要遵循临床研究的一般原则,良好的试验设计、高质量的数据、科学的统计分析是支持注册与监管决策的关键。为保证真实世界数据的质量符合监管要求,鼓励申请人在开展研究前与监管机构及时沟通交流。